TAVI – Comment choisir la bonne valve pour le bon patient :
« Tips and tricks » pour mieux comprendre vos staffs !
Le remplacement valvulaire aortique percutané par bioprothèse (ou Transcatheter Aortic Valve Implantation), dont la première intervention a été réalisée par le Professeur Alain Cribier à Rouen en 2002, apparait actuellement dans les dernières recommandations européennes comme le traitement de choix à proposer en première intention pour les patients souffrant d’une sténose aortique serrée symptomatique si le risque opératoire est évalué comme intermédiaire ou élevé(1).
Récemment, le TAVI a aussi démontré sa non-infériorité en comparaison avec la chirurgie conventionnelle chez des patients à bas risques sur un critère composite à 2 ans de suivi, et a même atteint la supériorité dans un autre essai randomisé sur un critère composite évalué à 1 an de suivi(2, 3). Il apparait donc évident que les patients bénéficiant de cette procédure seront dans un futur proche de plus en plus jeunes, moins comorbides, et avec une espérance de vie de plus en plus longue.
Ainsi, les défi s techniques actuels à relever dans l’implantation des bioprothèses aortiques sont donc importants. Il s’agit, dans un premier temps, d’obtenir le meilleur résultat hémodynamique possible (correction de la sténose sans fuite para prothétique ou mismatch) tout en évitant les complications péri-procédurales (hémodynamique, neurologique, vasculaire, ou rythmique). Par ailleurs, devant une espérance de vie de plus en plus longue chez les patients implantés d’un TAVI, la question de l’accessibilité future aux coronaires demeure primordiale. En outre, il faut anticiper le risque d’une éventuelle réintervention (TAVI-in-TAVI) en cas de dégénérescence de la bioprothèse TAVI.
Tous ces aspects doivent être pris en compte lors de la discussion en Heart-Team, afin d’optimiser la prise en charge de nos patients. Nous disposons actuellement de plusieurs types de valves sur le marché, permettant une personnalisation de la prise en charge en s’adaptant aux différentes situations cliniques et contraintes anatomiques pour un patient donné.
Nous vous proposons dans cet article d’aborder, dans un premier temps, les caractéristiques des deux principales bioprothèses utilisées en France. Par ailleurs, il faut également considérer le choix de la bonne taille de bioprothèse, garante d’un bon résultat hémodynamique sans fuite paraprothétique et/ou mismatch. Deux cas cliniques viendront illustrer de manière concrète cet article.
Exemples de bioprothèses TAVI utilisées en France
Actuellement, en France, nous avons plusieurs bioprothèses disponibles sur le marché. Nous aborderons dans cet article les deux principales valves utilisées en France.
Ces valves n’ont pas les mêmes propriétés biomécaniques, et les techniques d’implantation diffèrent selon la valve choisie. Par ailleurs, les taux de complications, notamment rythmiques, diffèrent selon la valve utilisée.
Certaines sont « auto-expandables », recapturables, et avec une position supra-annulaire, comme la valve Evolut Pro + (Medtronic). D’autres sont « ballon-expandables » et en position annulaire comme la Sapien 3 (Edwards).
Un résumé des différences principales entre les deux valves les plus utilisées en France est disponible dans le Tableau 1.
Tableau 1. Résumé des caractéristiques des deux valves les plus utilisées en France
Comment choisir
Vous l’aurez compris, chaque propriété énoncée plus haut doit être bien connue de l’opérateur afin de personnaliser la prise en charge. Idéalement, chaque centre de cardiologie interventionnelle habilité à réaliser des TAVI doit pouvoir disposer d’un minimum de deux types de bioprothèses afin de s’adapter aux différentes contraintes cliniques et anatomiques pour un patient donné. Le scanner pré TAVI est un élément crucial du bilan et permet de stratifier en amont le risque anatomique pour chaque étape clé de la procédure (abord fémoral, largage de la valve, risque de fuite para prothétique, risque de rupture annulaire, risque d’occlusion coronaire, risque de complication rythmique). Nous vous proposons donc d’étudier, en fonction des différents temps de la procédure TAVI, ce qui pourrait influencer le choix d’un type de bioprothèse (Tableau 2).
Les différents temps de la procédure, risques anatomique associés, et impact sur le choix de la bioprothèse TAVI
> Abord vasculaire
Il faut avoir un diamètre minimal de l’artère fémorale commune supérieur à 5,5 mm pour réaliser un TAVI. Les deux valves sont actuellement 14 Frenchs compatibles, on ne choisit donc pas un modèle de valve en fonction du diamètre de l’artère fémorale. Il faut garder en tête que les deux essais sur le TAVI chez les patients à bas-risque(2)(3) avaient inclus des patients aisément accessibles par voie fémorale, et nous manquons actuellement de données robustes de la littérature concernant les voies d’abord alternatives de TAVI comparé à la chirurgie pour ces patients.
La Figure 1 montre la stratification du risque anatomique concernant l’accès fémoral à un TAVI(4).
Figure 1. Stratification du risque anatomique concernant l’accessibilité à une voie périphérique fémorale.
Trois niveaux de risque existent selon les données du scanner (4).
> Zone d’implantation de la bioprothèse TAVI (Figure 2)
Les calcifications
La présence de calcifications sévères au niveau de la zone d’implantation de la bioprothèse TAVI (feuillets valvulaires, plan de l’anneau, et parfois extensive au niveau de la chambre de chasse du ventricule gauche) est associée à la survenue de complications importantes comme les fuites paravalvulaires, les ruptures annulaires, les troubles de la conduction, et les AVC péri-procéduraux(5).
Lever la sténose sans fuite para-prothétique est un des objectifs majeurs de la procédure. En effet, même les fuites modérées à moyennes sont associées à un moins bon pronostic, ce qui nous incite à post-dilater la valve implantée s’il en existe une au contrôle (angiographique, voire échographique selon les équipes)(6). Il faut donc garder à l’esprit que le « sizing » de la valve à l’aide du scanner est une étape clé dans la préparation de la procédure (cf. paragraphe dédié). Par ailleurs, les constructeurs ont fait évoluer les prothèses, qui sont maintenant « jupées » sur leur partie externe, ce qui permet de limiter ces fuites en partie. Enfin, la position de la valve par rapport au plan de l’anneau est également déterminante pour limiter le risque de ces fuites paravalvulaires (plus la prothèse est basse, plus le risque de fuite paravalvulaire est important), et l’aspect recapturable de la valve de Medtronic peut permettre d’optimiser ce largage.
Enfin, certaines calcifications de l’anneau, si elles sont particulièrement volumineuses et/ou protrusives en zone libre (c’est-à-dire non contenues par les structures fibreuses), exposent à un surrisque de rupture annulaire et donc de tamponnade. La présence de ces dernières peut orienter le choix vers une valve auto-expandable, bien que la valve ballon expandable soit aussi utilisable en prenant des précautions particulières.
Figure 2. Stratification du risque anatomique au niveau de la zone d’implantation du TAVI. Trois niveaux de risques existent selon la situation clinique et les données du scanner. Le choix d’une valve adaptée au patient, avec un sizing minitueux, associé à des techniques modernes d’implantation (cusp overlap technique, alignement commissural) permettent de réduire les complications péri-procédurales.
Aorte horizontale : La valve Sapien est sertie sur un système muni d’un cathéter orientable, ce qui favorise une meilleure délivrance co-axiale. Cependant, il existe certaines techniques de largage pour des opérateurs entrainés permettant de s’affranchir de ce cathéter orientable avec la valve auto-expandable de Medtronic.
Bicuspidie : Certaines bicuspidies, notamment les moins calcifiées, peuvent être traitées par TAVI. Parmi celle-ci, il faut mesurer le diamètre de la portion supra-annulaire. Si celle-ci est plus petite que l’anneau, alors il faut privilégier une valve auto-expandables.
Le risque de mismatch
Ce risque est particulièrement important dans les cas de « Valve in Valve » et dans les situations où l’anneau valvulaire natif est petit (compris entre 18 et 20mm).
Il peut être intéressant dans ces situations de privilégier des valves supra-annulaires, c’est-à-dire que la nouvelle surface de coaptation se fera au-dessus du plan de l’anneau valvulaire natif, afin de diminuer la charge en matériel au niveau du plan de l’anneau, permettant ainsi un meilleur résultat hémodynamique avec des gradients transvalvulaire moins élevés. L’essai thérapeutique randomisé SMART (NCT04722250) est en cours, et permettra d’apporter des éléments de réponse concernant le choix de bioprothèses TAVI sur la question des petits anneaux(7).
Le risque rythmique
Le risque d’être appareillé d’un stimulateur cardiaque peut être stratifié en amont de la procédure grâce à l’ECG de repos et aux données du scanner pré TAVI. Par ailleurs, l’utilisation des valves auto-expandables est associée à un surrisque rythmique, avec près de 17 % de complication rythmique nécessitant un stimulateur cardiaque dans un essai randomisé(2).
En effet, la présence d’un bloc de branche droit, et/ou la présence au scanner de calcification extensive au niveau des voies de conduction dans le septum membraneux (qui plus est, s’il est court), sont des facteurs de risques de développer des troubles de la conduction de haut degré. Il faut noter que certaines techniques d’implantation se sont développées récemment afin de limiter la profondeur d’implantation des bioprothèses TAVI, ce qui permet de diminuer les complications rythmiques(8). Il s’agit de la technique de largage en « cusp overlap »(9), valable également pour la valve Edwards(10). Ainsi, chez un sujet jeune avec bloc de branche droit pré-existant, il peut être intéressant de proposer une valve ballon expandable en privilégiant une position haute grâce à la technique de « cusp ovelap » afin de limiter le risque de survenue de trouble de la conduction de haut degré. Cependant, cette technique reste débattue. En effet une implantation haute expose en contrepartie à un surrisque d’occlusion coronaire aiguë péri-procédurale, et à celui de difficultés d’accès ultérieur aux coronaires.
Risque d’occlusion coronaire péri-procédurale
Les occlusions coronaires péri-procédurales sont des complications rares du TAVI qui surviennent dans moins de 1 % des cas, mais lorsqu’elles surviennent, le pronostic est sombre avec près de 40 % de mortalité à 1 mois(11).
Il existe des facteurs de risque connus qui permettent de repérer les situations à risques. Certains sont liés directement à l’anatomie du patient (hauteur des coronaires basse par rapport au plan de l’anneau aortique, sinus de Valsalva peu larges, calcifications excessives). D’autres sont liés à la procédure elle-même (hauteur d’implantation de la valve, procédure de Valve-In-Valve). Plusieurs techniques peuvent être proposées dans les cas à haut risque d’occlusion coronaire péri-procédurale. Certaines équipes préconisent la mise en place d’un guide de protection dans la coronaire afin de pouvoir la stenter si nécessaire, d’autres préconisent un stenting préventif et simultané des ostias de coronaires(12)(13).
> Accessibilité future aux coronaires
Chez un patient jeune et coronarien, ou à risque de le devenir, la question de l’accessibilité future aux coronaires reste primordiale(14). Actuellement, l’accès aux coronaires est facilité par l’utilisation de valve ballon expandable dont les cellules de l’armature sont larges, et le plus souvent implanté en dessous des ostias coronaires. Y accéder à travers une bioprothèse TAVI auto-expandable nécessite souvent un opérateur entrainé avec des techniques particulières. Il faut donc privilégier, au moment du largage de la valve, des méthodes permettant un alignement commissural (permettant d’obtenir ainsi un alignement des commissures de la bioprothèse avec les commissures natives) ce qui simplifie nettement l’accès ultérieur aux coronaires(15).
Enfin, chez les patients à bas risque dont l’espérance de vie attendue est longue, il faut anticiper la dégénérescence de bioprothèse et donc le risque inhérent de réintervention avec un « TAVI-in-TAVI ». Il s’agit de procédures complexes, avec un risque accru d’occlusion coronaire(16). Il peut être intéressant de proposer dans cette logique une première valve ballon expandable, suivie d’une valve auto-expandable en TAVI-in-TAVI si besoin, cette stratégie réduisant le risque d’occlusion coronaire. En anticipant la nécessité de réintervention, si l’anatomie est défavorable pour un futur TAVI-in-TAVI, il peut être intéressant de rediriger un patient donné vers la chirurgie afin d’anticiper plutôt un valve-in-valve.
Tableau 2. Avantages et inconvénients de la valve auto-expandable de Medtronic et de la valve ballon expandable de Edwards,
en fonction de la situation clinique.
Choix de la taille de la valve
Si le choix d’une valve adaptée pour chaque patient est primordial, le choix de la taille de cette dernière (« sizing ») l’est tout autant.
Le scanner pré-TAVI est un élément déterminant pour le sizing. Il va permettre de calculer avec précision l’aire (pour le choix de taille de la valve ballon expandable) et le périmètre (pour le choix de taille de la valve auto-expandable) ainsi que les diamètres moyens dérivés (pour le choix des deux types de valves) du plan de l’anneau aortique. C’est ensuite grâce à des abaques fournis par les industriels que nous pouvons choisir la taille de la bioprothèse correspondante. Ces abaques sont reproduits dans le tableau 3a et 3b.
Une valve auto-expandable peut être surtaillée (ou « oversizing ») : on peut ainsi choisir une taille au-dessus par rapport à ce que les abaques officiels nous proposent pour un périmètre annulaire donné. Adopter cette stratégie permet de réduire le risque de fuite para prothétique (en comblant au mieux les sinus). Cette stratégie d’oversizing est particulièrement utile dans les cas suivants :
• Lorsque l’on hésite entre deux tailles dans des zones grises de périmètre annulaire ; choisir une taille au-dessus permet d’assurer un meilleur comblement du sinus antéro gauche, tout spécialement intéressant pour diminuer le taux de fuite para-valvulaire.
• En présence de calcifications faisant redouter une rupture annulaire, nous préfèreront ne pas post-dilater la valve en cas de fuite résiduelle. Dans ce cas, on privilégiera une valve auto-expandable à la taille supérieure.
Mais attention, il existe une condition particulière pour pouvoir choisir une taille au-dessus : il faut que le diamètre moyen de sinus de Valsalva mesuré au scanner soit supérieur à la taille de la valve choisie.
Concernant le « sizing » d’une valve ballon expandable, si l’on hésite entre deux tailles de valve pour une surface limite (entre une Sapien 3 n°23 et n°26 par exemple), alors on peut moduler le niveau d’inflation de la valve selon la quantité de contraste remplissant le ballon. Il s’agit d’un ajustement volumique de l’inflateur, permettant de « down » ou « oversizer » une Sapien 3 et lui permettre de s’ajuster à la taille de l’anneau du patient(18,19). En effet, si le risque de rupture annulaire est faible (absence de calcification faisant redouter une rupture annulaire par exemple), alors on peut se permettre le choix d’une valve à la taille au-dessus (une Sapien 3 n°26 dans cet exemple), et l’inflater avec 1 ou 2 cc de moins de produit de contraste que ne le voudrait la valeur de pression nominale. En cas de fuite para-valvulaire, on pourra alors post-dilater la valve à la valeur de pression nominale.
a. Pour les valves auto expandable Medtronic (Evolut R et Evolut PRO)
b. Pour les valves ballon expandable Edwards (Sapien 3)
Tableau 3. Abaques pour le sizing des valves Medtronic et Edwards
Cas cliniques
Cas 1
Patient de 88 ans, adressé pour RAC serré symptomatique sur valve aortique tricuspide.
Il existe une coronaropathie associée avec une sténose serrée de l’IVA proximale stentée il y a 10 ans, recontrôlée sans resténose intra stent et sans évolution de la maladie athéromateuse par ailleurs sur la dernière coronarographie. Il a été implanté d’un pace maker double chambre il y a 4 ans pour un BAV complet.
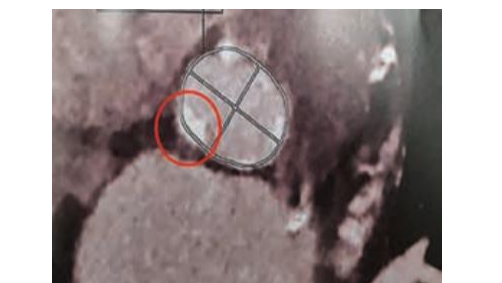
Le TDM pré TAVI montre : une valve aortique tricuspide, l’anneau extrêmement calcifié avec un nodule en regard de la paroi libre. Périmètre de la valve : 72 mm. Diamètre minimum : 26 mm ; diamètre maximal : 29mm. Le diamètre moyen des sinus de Valsalva est mesuré à 31 mm (Figure 3).
Par ailleurs, les hauteurs des deux ostias coronaires par rapport au plan de l’anneau sont supérieures à 12 mm et les voies fémorales mesurées à 9 mm, sont accessibles des deux côtés.
Figure 3. Exemple d’une calcification en regard du plan de l’anneau aortique à risque de complication sur un scanner pré TAVI
Questions
A. Vous décidez d’implanter une Evolut Pro 26
B. Vous décidez d’implanter une Evolut Pro 29
C. Vous décidez d’implanter une Sapien 3 26
D. Vous décidez d’implanter une Sapien 3 29
Commentaire : Plusieurs éléments nous orientent vers le choix d’une valve auto-expandable : d’une part l’aspect très calcifié de l’anneau, afin de diminuer le risque de rupture et d’optimiser le résultat hémodynamique (meilleure diminution des gradients par l’aspect supra-annulaire de la prothèse). D’autre part, le fait que le patient soit déjà appareillé d’un pacemaker, la question du sur-risque rythmique lié à une bioprothèse auto-expandable de type Evolut n’a plus lieu d’exister.
Au vu de la coronaropathie, il faudra rester attentif, au moment du largage, à réaliser celui-ci dans les conditions permettant un bon alignement commissural même si, au vu de l’âge, le risque de réintervention coronaire est faible.
Concernant le choix de la taille, il faut noter ici que le périmètre de la valve est à 72 mm, ce qui correspond en pratique à une zone grise dans les abaques de choix (cf. tableau 3). Choisir une valve Evolut Pro 26 nous exposerait à un risque non négligeable de régurgitation para-valvulaire. Il faut noter aussi la forme elliptique de l’anneau, avec un grand diamètre ici mesuré à 29 mm. Donc si l’on choissisait une Evolut 26, la fuite paravalvulaire serait importante et ne serait pas corrigeable par une post dilatation (la valve ne pouvant pas dépasser 26 mm). Ici, le diamètre moyen mesuré des sinus de Valsalva est à 31mm. On peut donc choisir une taille au-dessus, c’est-à-dire une Evolut Pro + 29.
Après discussion en Heart Team, il a donc été décidé d’implanter une Valve auto expandable Evolut R Pro + 29 (Medtronic).
Cas 2
Patient de 72 ans, adressé pour RAC serré symptomatique sur valve aortique tricuspide.
Il est porteur d’une coronaropathie pré-existante à la découverte de ce RAC avec des lésions bi-tronculaires, revascularisé par un stent actif sur la coronaire droite moyenne, et la circonfl exe moyenne. Pas d’autre comorbidités.
Le TDM pré TAVI montre : une valve aortique tricuspide modérément calcifi ée. Absence de calcifi cation protrusive en zone libre. Surface de la valve : 510 mm2 . Le diamètre dérivé de l’aire est à 26 mm. La hauteur des coronaires est à 15 mm pour le tronc commun est à 13 mm pour la coronaire droite.
Le patient refuse la chirurgie. Il est accessible à un TAVI par voie fémorale.
Questions
A. Vous décidez d’implanter une Evolut R 26
B. Vous décidez d’implanter une Evolut R 29
C. Vous décidez d’implanter une Sapien 3 26
D. Vous décidez d’implanter une Sapien 3 29
Commentaire : Ici, plusieurs arguments plaident en faveur d’une valve ballon expandable :
• Patient jeune et coronarien, avec la nécessité de prendre en compte l’accessibilité future aux coronaires (plus simple avec une valve ballon expandable).
• Risque de dégénérescence de la bioprothèse à prendre en compte ici (par l’espérance de vie attendue chez jeune patient). Ainsi, ce patient est à risque de se voir proposer une procédure de TAVI-in-TAVI. Il s’agit de procédure complexe, avec un risque d’occlusion coronaire. Cependant, le choix d’une prothèse ballon expandable comme première bioprothèse permet sans doute de réduire ce risque, en comparaison à une valve supra annulaire.
Il a donc été décidé en HEART Team d’implanter ce patient avec une bioprothèse SAPIEN 3 26 (Edwards).
Conclusions
Le remplacement valvulaire percutané par TAVI s’est considérablement amélioré ces dernières années, en lien avec la courbe d’apprentissage naturelle liée à la technique, une amélioration notable du matériel, et une meilleure préparation des procédures grâce aux données du scanner qui est une étape cruciale.
Le « sizing » de la valve, garant d’un bon résultat hémodynamique sans fuite para-valvulaire, doit être extrêmement précis. Dans la majorité des cas, nous pouvons traiter les patients avec les deux prothèses présentées dans cet article. Cependant, dans certaines situations, certains facteurs notamment cliniques (âge, coronaropathie pré existante), électrique (haut risque de survenue de trouble de la conduction de haut grade), et ou anatomiques vont plaider en faveur de l’une ou l’autre, permettant ainsi de personnaliser la prise en charge. Aussi, devant une espérance de vie de plus en plus longue de nos patients traités par TAVI, il faut également mettre en avant la question de l’accessibilité future aux coronaires, ainsi que le risque de dégénérescence de bioprothèse et donc le risque inhérent de réintervention. Tous ces éléments doivent être considérés lors de la discussion initiale en Heart Team.
Bibliographie
1. Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022 Feb 12;43(7):561–632.
2. Popma JJ, Deeb GM, Yakubov SJ, Mumtaz M, Gada H, O’Hair D, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019 May 2;380(18):1706–15.
3. Mack MJ, Leon MB, Thourani VH, Makkar R, Kodali SK, Russo M, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019 May 2;380(18):1695–705.
4. Windecker S, Okuno T, Unbehaun A, Mack M, Kapadia S, Falk V. Which patients with aortic stenosis should be referred to surgery rather than transcatheter aortic valve implantation? Eur Heart J. 2022 Apr 25;ehac105.
5. Ko E, Kang DY, Ahn JM, Kim TO, Kim JH, Lee J, et al. Association of aortic valvular complex calcification burden with procedural and longterm clinical outcomes after transcatheter aortic valve replacement. Eur Heart J Cardiovasc Imaging. 2021 Sep 7;jeab180.
6. Okuno T, Tomii D, Heg D, Lanz J, Praz F, Stortecky S, et al. Five-year outcomes of mild paravalvular regurgitation after transcatheter aortic valve implantation. EuroIntervention. 2022 May 15;18(1):33–42.
7. Herrmann HC, Abdel-Wahab M, Attizzani GF, Batchelor W, Bleiziffer S, Verdoliva S, et al. Rationale and design of the SMall Annuli Randomized To Evolut or SAPIEN Trial (SMART Trial). Am Heart J. 2022 Jan;243:92–102.
8. Mendiz OA, Noč M, Fava CM, Gutiérrez Jaikel LA, Sztejfman M, Pleskovič A, et al. Impact of Cusp-Overlap View for TAVR with SelfExpandable Valves on 30-Day Conduction Disturbances. J Interv Cardiol. 2021;2021:9991528.
9. Ben-Shoshan J, Alosaimi H, Lauzier PT, Pighi M, Talmor-Barkan Y, Overtchouk P, et al. Double S-Curve Versus Cusp-Overlap Technique: Defining the Optimal Fluoroscopic Projection for TAVR With a Self-Expanding Device. JACC Cardiovasc Interv. 2021 Jan 25;14(2):185–94.
10. Sammour Y, Banerjee K, Kumar A, Lak H, Chawla S, Incognito C, et al. Systematic Approach to High Implantation of SAPIEN-3 Valve Achieves a Lower Rate of Conduction Abnormalities Including Pacemaker Implantation. Circ Cardiovasc Interv. 2021 Jan;14(1):e009407.
11. Ribeiro HB, Webb JG, Makkar RR, Cohen MG, Kapadia SR, Kodali S, et al. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation: insights from a large multicenter registry. J Am Coll Cardiol. 2013 Oct 22;62(17):1552–62.
12. Palmerini T, Chakravarty T, Saia F, Bruno AG, Bacchi-Reggiani ML, Marrozzini C, et al. Coronary Protection to Prevent Coronary Obstruction During TAVR: A Multicenter International Registry. JACC Cardiovasc Interv. 2020 Mar 23;13(6):739–47.
13. Garot P. TAVR-Related Coronary Obstruction: Preventive Wires or Stenting? JACC Cardiovasc Interv. 2020 Mar 23;13(6):748–50.
14. Yudi MB, Sharma SK, Tang GHL, Kini A. Coronary Angiography and Percutaneous Coronary Intervention After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2018 Mar 27;71(12):1360–78.
15. Tang GHL, Zaid S, Fuchs A, Yamabe T, Yazdchi F, Gupta E, et al. Alignment of Transcatheter Aortic-Valve Neo-Commissures (ALIGN TAVR): Impact on Final Valve Orientation and Coronary Artery Overlap. JACC Cardiovasc Interv. 2020 May 11;13(9):1030–42.
16. Ochiai T, Oakley L, Sekhon N, Komatsu I, Flint N, Kaewkes D, et al. Risk of Coronary Obstruction Due to Sinus Sequestration in Redo Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2020 Nov 23;13(22):2617–27.
17. Okuno T, Asami M, Heg D, Lanz J, Praz F, Hagemeyer D, et al. Impact of Left Ventricular Outflow Tract Calcification on Procedural Outcomes After Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2020 Aug 10;13(15):1789–99.
18. Ihdayhid AR, Leipsic J, Hahn RT, Pibarot P, Thourani V, Makkar R, et al. Impact of Annular Oversizing on Paravalvular Regurgitation and Valve Hemodynamics: New Insights From PARTNER 3. JACC Cardiovasc Interv. 2021 Oct 11;14(19):2158–69.
19. Garot P. Oversizing TAVR in the Low-Risk Era: Is Bigger Still Better? JACC Cardiovasc Interv. 2021 Oct 11;14(19):2170–2.
Dr Emmanuel GALL
Docteur junior de cardiologie interventionnelle,
CHU Lariboisière (APHP),
Paris
Dr Alexandre LAFONTPH
de cardiologie interventionnelle,
CHU Lariboisière (APHP),
Paris
Dr Philippe GAROT
Cardiologue interventionnel,
Institut Cardiovasculaire
Paris Sud (ICPS), Massy
Article paru dans la revue “ Collèges des Cardiologues en Formation ” / CCF n°17

