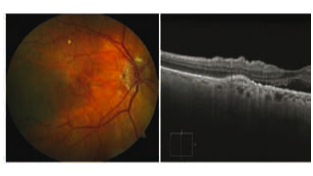
DMLA
La Dégénérescence Maculaire Liée à l’Âge est la 1ère cause de malvoyance après 50 ans dans les pays industrialisés. Souvent bilatérale et asymétrique, elle touche la partie centrale de la rétine. On peut la définir comme un stade évolué de vieillissement de la macula due à une accumulation de drusens engendrant des anomalies rétiniennes.
Les patients atteints sont souvent âgés de plus de 50 ans. On retrouve comme facteurs de risques : l’ethnie, le régime alimentaire, l’âge, la consommation de tabac, l’hérédité (ATCD familiaux), l’hypertension, les maladies cardiovasculaires, l’exposition prolongée au soleil. [1]
Elle peut-être de 2 types :
- Atrophique (ou DMLA sèche) : perte de cellules de l’épithélium pigmentaire et des segments externes des photorécepteurs dans la zone centrale de la rétine altèrant la vision précise [2]
- Exsudative (ou DMLA humide) : apparition de néovaisseaux choroïdiens dans la région maculaire [3]
Les patients se plaindront de :
- Baisse de l’acuité visuelle
- Scotome central
- Altération de la vision des couleurs
- Métamorphopsies (déformations des lignes) [1]
Le suivi de la DMLA exsudative nécessite la réalisation de plusieurs examens :
- DMLA exsudative :
- OCT maculaire : néovaisseaux, décollement séreux rétinien et logettes ;
- RNM (rétinophotographie non mydriatique) ;
- Angiographie à la fluorescéine +/- indocyanine [4] ou d’angio-OCT permettant d’éviter une injection de colorant pour mettre en évidence les néo vaisseaux.
- DMLA atrophique :
- OCT maculaire : amincissement de la rétine centrale, drusens ;
- Autofluorescence : altération de l’épithélium pigmentaire (zone hypo réflective) ;
- RNM (rétinophotographie non mydriatique) [5].
Pour ce qui est de la prise en charge, le patient pourra auto-surveiller sa maladie à l’aide de la Grille d’Amsler en format papier ou via l’application smartphone “OdySight”. [5,8]
On recommande également aux patients une bonne hygiène de vie : alimentation riche en antioxydants, éviter le tabac, se protéger du soleil à l’aide de filtre, d’une casquette…
Concernant les traitements, nous avons plusieurs solution pour la forme humide :
Les injections intravitréennes (= IVT) d’anti-VEGF : empêchent l’évolution de la maladie en bloquant l’apparition de nouveaux néovaisseaux et en asséchant les néovais-seaux actifs (diminution de l’œdème maculaire) ; 2 médicaments sont principalement utilisés :
L’aflibercept (Eylea)
Le ranibizumab (Lucentis)
La thérapie photodynamique (PDT) : c’est le traitement de 2ème intention, elle consiste à thromboser les néovaisseaux choroïdiens grâce à un laser infrarouge.
Contrairement à la DMLA exsudative, aucun traitement médical n’est à ce jour existant pour la forme atrophique [6].
Une surveillance rapprochée est effectuée par l’ophtalmologue afin d’évaluer l’intervalle des injections et le développement de la maladie.
Étant une maladie chronique, les patients atteints de DMLA rentrent dans le cadre de la basse vision selon l’évolution de leur pathologie. Afin de faciliter leur quotidien et leur autonomie, des aides optiques, de la rééducation de leur vision fonctionnelle peuvent être mises en place par l’orthoptiste en collaboration avec l’opticien [7].
Dans certains CHU il est proposé aux patients des séances d’éducation thérapeutique. Ces dernières ont pour but de faire comprendre aux patients, et à leur entourage, leurs maladies afin qu’ils puissent mieux vivre avec. Elles sont organisées par des ophtalmologistes, orthoptistes et infirmiers.
Bibliographie
[1]. Dot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 235-236
[2]. Le Lez ML, Halfon J. Rapport SFO 2019 : OCT en ophtalmologie ; 131
[3]. Semoun O, Srour M, Souied EH. Rapport SFO 2016 : Oedèmes maculaires ; 491
[4]. Laversin S, Trellu S, Thierry T. HAS - Recommandations des bonnes pratiques Dégénérescence maculaire liée à l’âge ; 15
[5]. Dot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 237-238
[6]. Laversin S, Trellu S, Thierry T. HAS - Recommandations des bonnes pratiques : Dégénérescence maculaire liée à l’âge ; 11
[7]. Laversin S, Trellu S, Thierry T. HAS - Recommandations des bonnes pratiques : Dégénérescence maculaire liée à l’âge ; 18
Morgane GUEX-CROSIER et Clémence JEANNETEAU
Cataracte
Il s’agit d’une opacification du cristallin le plus souvent liée à l’âge. Toutefois elle peut également être traumatique, secondaire (à des pathologies ophtalmologiques, iatrogène, métabolique ou génétique) ou encore congénitale. Il s’agit de la chirurgie la plus fréquente, toute chirurgie confondue, en France.
Signes fonctionnels :
- Baisse d’acuité visuelle, davantage en vision de loin.
- Modification de la perception des couleurs (jaunissement).
- Photophobie.
- Diplopie monoculaire, dans des cas plus rares.
- Halos lumineux [1].
L’ophtalmologiste évalue la densité et l’importance de la cataracte à l’examen de la lampe à fente. Lorsqu’une intervention est envisagée, les examens à réaliser sont : [1]
- Biométrie avec calcul de la puissance de l’implant qui remplace le cristallin ;
- RNM ;
- Microscope spéculaire afin de rechercher la présence d’un facteur de risque de décompensation endothéliale post-opératoire ;
- OCT maculaire afin d’anticiper une fragilité rétinienne maculaire pré existante ;
- OCT papillaire en vue de s’affranchir d’une pathologie concomitante (ex : glaucome).
Afin de calculer la puissance de l’implant qui remplacera le cristallin, deux paramètres sont indispensables :
- La kératométrie (puissance de la cornée).
- La longueur axiale (longueur de l’oeil).
Si nous n’arrivons pas à obtenir ces valeurs à la biométrie, il nous est possible d’avoir à l’aide de l’échographie A (de
moindre qualité) pour la longueur de l’œil et l’auto réfractomètre ou encore la topographie cornéenne pour les valeurs de kératométrie [1].
La technique afin de retirer le cristallin est appelée la phacoémulsifi cation : des ultrasons permettent de casser le cristallin pour pouvoir mettre à sa place l’implant. À noter que différents types d’implants existent : unifocaux, multifocaux, toriques... [2]
Les complications post-opératoires peuvent être :
Décompensation endothéliale ;
- Décollement de rétine ;
- Cataracte secondaire ;
- Endophtalmie ;
- Irvin Gass (oedème maculaire) [3].
Dans le cadre de la cataracte secondaire, à savoir qu’il s’agit d’une opacification du sac cristallinien, le laser YAG est utilisé. Il est réalisé afi n de supprimer les cellules cristalliniennes proliférantes (non retirées lors de la phakoémulsifi cation) s’agrégeant au niveau de l’implant créant des opacités centrales entraînant une baisse d’acuité visuelle progressive [4].
Bibliographie
[1]. Fournié P. Collège des Ophtalmologistes Universitaires de France (COUF) ; 208-210
[2]. Fournié P. Collège des Ophtalmologistes Universitaires de France (COUF) ; 214
[3]. Fournié P. Collège des Ophtalmologistes Universitaires de France (COUF) ; 216-218
[4]. Milazzo S, Grenot M, Benzerroug M. Journal d’ophtalmologie français (2014) Vol 37 : la cataracte secondaire ; 826
Morgane GUEX-CROSIER et Clémence JEANNETEAU
Glaucome
Le glaucome est une neuropathie optique d’évolution progressive par apoptose accélérée des cellules ganglionnaires rétiniennes et des cellules du nerf optique. On a donc une atteinte structurelle (papille) et fonctionnelle (champ visuel) pouvant aboutir à une cécité [1].
On distingue principalement 3 types de glaucomes mais il en existe d’autres :
- Le glaucome primitif à angle ouvert (GPAO) ;
- Le glaucome à angle ouvert secondaire (GAO secondaire) ;
- Le glaucome aigu par fermeture d’angle (GAFA) [2].
GPAO
Le glaucome primitif à angle ouvert est la 2nde cause de cécité dans le monde. Les facteurs de risques de développer un glaucome sont :
- L’âge (> 40 ans) ;
- L’hypertonie oculaire ;
- Les ATCD familiaux directs ;
- L’origine ethnique (mélanoderme) ;
- La myopie [3].
SF : pas de plaintes particulières, acuité visuelle préservée sauf dans les stades tardifs du glaucome [4].
Les examens nécessaires au suivi du glaucome sont :
- Un OCT de la papille pour observer l’épaisseur des fibres optiques.
- Un champ visuel.
- Un fond d’oeil pour observer l’excavation papillaire.
- Une gonioscopie.
- RNM de la papille.
Au champ visuel, on retrouve fréquemment un scotome arciforme de Bjerrum, un ressaut nasal et d’autres déficits paracentraux. Sans traitement, le champ visuel va se dégrader jusqu’à devenir tubulaire [4].
Un GPAO peut se compliquer d’une occlusion de la veine centrale de la rétine, due à une hypertonie oculaire [5].
Le 1er traitement du GPAO est de diminuer la pression intra-oculaire via des collyres hypotonisants [6]. Si ce traitement médical ne suffi t pas, il est possible d’effectuer :
- Une trabéculoplastie laser : photo coagulation au niveau de l’angle irido-cornéen pour permettre un meilleur écoulement de l’humeur aqueuse.
- Une chirurgie :
- Chirurgie fi ltrante : trabéculectomie qui consiste à retirer le trabéculum pour faire communiquer l’humeur aqueuse avec l’espace sous-conjonctival via un volet scléral [7].
- Chirurgie filtrante non perforante : sclérectomie profonde qui consiste en une exérèse partielle du trabéculum [8].
- Chirurgie de la cataracte avec pose d’un implant XEN : le cristallin de par son épaisseur peut altérer la bonne circulation de l’humeur aqueuse, son retrait et la pose d’un implant intra-oculaire adapté (plus fi n, ...) permet d’améliorer cette circulation d’humeur aqueuse.
- Chirurgie avec pose d’un implant XEN +/- combinée à une chirurgie de la cataracte : implant très très fi n permettant de réguler la circulation de l’humeur aqueuse qu’il soit associé au cristallin naturel ou à un implant pseudo-phake.
D’autres techniques chirurgicales dites “micro-invasives” sont en cours de développement (par exemple, la chirurgie de la cataracte avec pose d’un implant iStent qui permet de réguler la circulation de l’humeur aqueuse) [9].
GAFA
Le glaucome aigu par fermeture d’angle est dû à un positionnement anormal de l’iris contre la trabéculum, empêchant ainsi l’écoulement physiologique de l’humeur aqueuse qui entraîne une augmentation extrêmement importante de la PIO.
Le GAFA a une évolution fulgurante et douloureuse contrairement au GPAO d’évolution lente et insidieuse. Il y a un risque majeur de perte de fonction visuelle du fait de l’augmentation de la PIO.
Le traitement va consister à baisser la PIO pour engendrer le moins de séquelles anatomiques et visuelles possible. Un traitement est effectué afin de réouvrir l’angle irido-cornéen par iridotomie laser ou via une chirurgie de la cataracte, l’écoulement de l’humeur aqueuse est ainsi facilité. Si la chirurgie n’est pas suffi samment efficace, les traitements à suivre seront les mêmes que dans le GPAO, à commencer par les collyres hypotonisants [10].
Bibliographie
[1]. Schweitzer C, Giraud J-M, Fénolland J-R, Renard J-P. Rapport SFO 2019 : OCT en ophtalmologie ; 401
[2]. Aptel F, Rouland J-F, Bron A. Collège des ophtalmologistes universitaires de France (COUF) : 221
[3]. Bron A, Chaine G, Villain M, Colin J, J.-P. Nordmann J-P, Renard J-P, Rouland J-F. Journal français d’ophtalmologie (2008) Vol 31 ; 436-440
[4]. Aptel F, Rouland J-F, Bron A. Collège des ophtalmologistes universitaires de France (COUF) : 222-225
[5]. Pierru A, Girmens J-F, Héron E, Paques M. Journal français d’ophtalmologie (2010) Vol 40 ; 704
[6]. Sellem E, Renard J-P. Rapport SFO 2014 : glaucome primitif à angle ouvert ; chapitre 15
[7]. Hamard P. Rapport SFO 2014 : glaucome primitif à angle ouvert ; chapitre 16 - abaisser la PIO
[8]. Brasnu E, Hamard P, Roy S, Baudouin C. Rapport SFO 2014 : glaucome primitif à angle ouvert ; chapitre 16 - abaisser la PIO
[9]. Aptel F. Rapport SFO 2014 : glaucome primitif à angle ouvert ; chapitre 16 - perspectives thérapeutiques
[10]. Aptel F, Rouland J-F, Bron A. Collège des ophtalmologistes universitaires de France (COUF) : 227-228
Morgane GUEX-CROSIER et Clémence JEANNETEAU
Paralysies oculomotrices dans les grandes lignes
POM VI
La paralysie du VI (nerf abducens) est la paralysie oculomotrice la plus fréquente. Elle entraîne un déficit d’abduction de l’œil pathologique par atteinte du droit latéral.
Cette paralysie est à l’origine d’une diplopie binoculaire horizontale et entraîne une ésotropie de l’œil paralysé en position primaire, qui se majore dans le champ d’action du muscle droit latéral atteint et qui diminue dans le regard opposé.
Une position compensatrice de la tête peut être adoptée par le patient : torticolis tête tournée du côté de l’atteinte [1].
Les examens à réaliser sont :
- Examen sous écran et une déviométrie ;
- Examen de la motilité ;
- Lancaster.
Comme dit précédemment à l’examen sous écran, une ésotropie plus ou moins importante, selon l’atteinte, est retrouvée de l’œil paralysé. La motilité permet de quantifier le déficit d’abduction dans le champ du muscle atteint. Ce déficit engendre une variation de l’angle selon la direction du regard, une déviométrie en version droite et gauche est donc intéressante à effectuer pour quantifier cette variation d’angle.
Les muscles oculomoteurs répondants aux lois de Hering et Sherrington, nous retrouverons au Lancaster :
- Une hypoaction dans le champ d’action du muscle droit latéral paralysé ;
- Une hyperaction dans le champ d’action du muscle antagoniste homolatéral (droit médial) ;
- Une hyperaction dans le champ d’action du muscle agoniste controlatéral (droit médial) ;
- Une hypoaction secondaire dans le champ d’action du muscle antagoniste controlatéral (droit latéral) [2].
La prise en charge effectuée est variable selon l’évolution de la paralysie et donc selon son étiologie. Une paralysie du VI d’origine microvasculaire a un très bon pronostic, une récupération spontanée est fréquemment observée dans les 3 mois qui suivent [3].
Dans un premier temps, pour supprimer la diplopie et soulager le patient, un cache peut être apposé, à mettre de manière alterné, sur un œil puis l’autre, afin de lutter contre des contractures. Si la déviation persistante est minime et stable, un prisme base temporale devant l’œil paralysé peut être proposé.
Dans le cas où aucune récupération est observée au bout de 3 mois, une injection de toxine botulique dans le droit médial homolatéral du muscle paralysé est envisageable. Cette injection permettra d’accélérer la récupération, si elle doit avoir lieu.
Après un an d’évolution de la paralysie, un traitement chirurgical est proposé au patient [4].
Bibliographie
[1]. Sauer A, Speeg-Schatz C. Rapport SFO 2013 : Strabisme ; 259-260
[2]. Santallier M. Motricité et sensorialité oculaire : l’examen ; 239
[3]. Lebranchu P. Rapport SFO 2020 : Neuro-ophtalmologie en pratique ; 326
[4]. Sauer A, Speeg-Schatz C. Rapport SFO 2013 : Strabisme ; 261
POM IV
La paralysie du IV (nerf trochléaire) entraîne un déficit d’abaissement en adduction de l’œil pathologique par atteinte de l’oblique supérieur.
Cette paralysie est à l’origine d’une diplopie binoculaire verticale/oblique pouvant engendrer un torticolis menton abaissé et tête penchée sur l’épaule du côté sain [1].
Les examens à réaliser sont :
- Examen sous écran et une déviométrie ;
- Manoeuvre de Bielschowsky ;
- Examen de la motilité ;
- Lancaster.
À la motilité, on retrouve une limitation de l’abaissement en adduction de l’œil atteint. À l’examen sous écran, on voit une ésotropie ainsi qu’une hauteur (hypertropie) de l’œil pathologique avec une déviation augmentant dans le champ d’action de l’oblique supérieur et qui diminue dans le regard opposé. Une déviométrie dans les 9 positions du regard est donc intéressante à effectuer pour quantifier cette variation d’angle.
La manœuvre de Bielschowsky est une mesure de la déviation, en vision de loin, tête penchée sur l’épaule droite puis sur l’épaule gauche. Dans une POM du IV on observe que l’hypertropie augmente du côté de l’épaule atteinte [1].
Une excyclotorsion pourra être retrouvée à la RNM ou encore via la paroi de Harms car l’oblique supérieure est incyclotorseur [2].
D’après les lois de Hering et Sherrington nous retrouverons au Lancaster :
- Une hypoaction dans le champ d’action du muscle oblique supérieur paralysé ;
- Une hyperaction dans le champ d’action du muscle antagoniste homolatéral (oblique inférieur) ;
- Une hyperaction dans le champ d’action du muscle agoniste controlatéral (droit inférieur) ;
- Une hypoaction secondaire dans le champ d’action du muscle antagoniste controlatéral (droit supérieur) [2].
Dans un premier temps, pour supprimer la diplopie et soulager le patient, un cache peut être apposé, à mettre de manière alterné, sur un œil puis l’autre, afin de lutter contre des contractures. En raison de la variation d’angle entre la déviation verticale et la torsion, la prismation est peu utilisée.
À l’instar d’une POM du VI, la chirurgie oculomotrice est indiquée après une stabilisation clinique d’au moins un an, pour laisser le temps à une possible récupération spontanée [3].
Bibliographie
[1]. Lebranchu P. Rapport SFO 2020 : Neuro-ophtalmologie en pratique ; 320
[2]. Klainguti G, Kaeser P-F. Rapport SFO 2013 : Strabisme ; 256
[3]. Klainguti G, Kaeser P-F. Rapport SFO 2013 : Strabisme ; 258
POM III
La POM du III (nerf oculomoteur commun) présente différents tableaux cliniques selon l’origine de l’atteinte [1]. La cause microvasculaire est la 1ère cause de la POM du III chez l’adulte et également la plus grave car elle peut être due à une rupture d’anévrisme, à éliminer d’urgence [2].
Pour rappel, le III innerve des éléments extrinsèques (RPS, DS, DM, OI, DI) mais également des éléments intrinsèques (muscle ciliaire et sphincter de l’iris). Lors d’une paralysie, l’intégralité de ces éléments ou seulement une partie peuvent être atteints [3].
Si toute la musculature extrinsèque est atteinte, on retrouvera :
- Un ptosis (pouvant masquer la diplopie) ;
- Une exotropie ainsi qu’une hypotropie ;
- Un déficit d’abaissement, d’élévation et d’adduction [3].
Attention : en cas d’observation d’une mydriase unilatérale d’un patient, il faudra éliminer d’urgence la cause anévrismale. Dans ce cas, la récupération sera moyenne, voire nulle a contrario d’une atteinte ischémique avec un excellent pronostic [4].
Bibliographie
[1]. Lebranchu P. Rapport SFO 2020 : Neuro-ophtalmologie en pratique ; 316-317
[2]. Lebranchu P. Rapport SFO 2020 : Neuro-ophtalmologie en pratique ; 319
[3]. Costet Ch. Rapport SFO 2013 : Strabisme ; 250
[4]. Fang C, Leavitt JA, Hodge DO, et al. Incidence and etiologies of acquired third nerve palsy using a opulation-based method. JAMA Ophthalmol 2017;135:23–8.
D’après les lois de Hering et Sherrington, on retiendra que lors d’une POM on retrouvera :
- Paralysie du muscle
- Hyperaction de l’antagoniste homolatéral
- Hyperaction de l’agoniste controlatéral
- Hypoaction de l’antagoniste controlatéral [1]
Pour les traitements de la diplopie consécutive à la paralysie oculomotrice, on retient les solutions suivantes :
- Occlure un oeil puis l’autre pour supprimer la diplopie et éviter les contractures ;
- Prismer : seulement dans le cadre des petites déviations ;
- La chirurgie oculomotrice : à envisager après une stabilisation de l’angle, au moins 12 mois après la paralysie [2].
[1]. Pechereau A, Rapport SFO 2013 : Strabisme ; 490
[2]. Lebranchu P. Rapport SFO 2020 : Neuro-ophtalmologie en pratique ; 371-372
Morgane GUEX-CROSIER et Clémence JEANNETEAU
Article paru dans la revue « Le magazine de la Fédération Française des Étudiants en Orthoptie » / FFEO N°01

